اثر همافزای نانوذرات اکسید روی و مروپنم بر تشکیل بیوفیلم در باکتری Pseudomonas aeruginosa
سودوموناس آئروژینوزا به عنوان بخشی از فلور طبیعی روده شناخته میشود و یک پاتوژن مهم که مسئول انواع عفونتهای اکتسابی در بخش مراقبتهای ویژه (ICU) در بیماران میباشد. عفونتهای بیمارستانی مرتبط با این ارگانیسم شامل مننژیت، عفونتهای خون، عفونتهای دستگاه ادراری، عفونتهای دستگاه تنفسی، عفونتهای زخم و اوتیت میانه است. سودوموناس آئروژینوزا میتواند به عنوان یک باکتری فرصتطلب با عفونتهای بهداشتی در VAP، ICU، عفونتهای محل جراحی، زخمهای سوختگی، کراتیت مرتبط باشد.
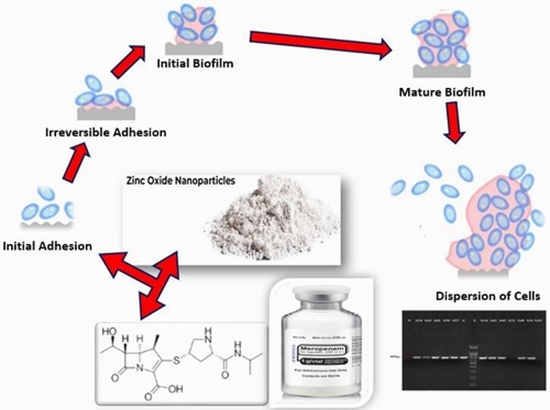
بیوفیلمها جوامع متشکل از باکتری هستند که از یک ماتریکس پلیمری خارجسلولی تشکیل شدهاند. این ماتریکس توسط باکتریهای ثابت تولید میشود و به سطوح زیستی و غیرزیستی میچسبد. ساختار سهبعدی بیوفیلم شامل پلیساکاریدها، پروتئینها، آنزیمها، DNA، گلیکولیپیدهای باکتریایی، آب و میکروارگانیسمها است. بیوفیلم، باکتریها را در برابر سیستم ایمنی ذاتی و درمان آنتیبیوتیکی محافظت میکند. مقاومت در برابر سیستم ایمنی به دلیل تغییرات مکرر در آنتیژنهای سطحی است. تغییر آنتیژنهای سطحی از طریق تغییرات در بیان ژنها ممکن است.
بیوفیلم میتواند عفونتهای مداوم مرتبط با سودوموناس آئروژینوزا را افزایش دهد و سطح مقاومت آنتیبیوتیکی بالاتری نسبت به سلولهای باکتریایی پلانکتونیک ایجاد کند. درمان عفونتهای ناشی از چنین ارگانیسمهایی به دلیل وجود مقاومت ذاتی آنها به انواع مختلف آنتیبیوتیکها، به ویژه بتا-لاکتام و پنم، همراه با توانایی آنها در کسب مکانیسمهای مقاومتی بیشتر به چندین نوع آنتیبیوتیک مانند فلوئورکینولونها، آمینوگلیکوزیدها و بتا-لاکتامها، دشوار است. باکتریها در بیوفیلم مقاومت قابل توجهی در برابر آنتیبیوتیکها، کاهش نرخ رشد، ترشح مولکولهای سطحی مختلف و عوامل بیماریزای دیگر دارند که باعث افزایش بیماریزایی آنها میشود. مطالعات گذشته نشان دادهاند که بسیاری از میکروبها در برابر ترکیبات سمی، از جمله آنتیبیوتیکها، در کشتهای پلانکتونیک یا مراحل اولیه تشکیل بیوفیلم حساس هستند، در حالی که بیوفیلمهای بالغ در برابر سموم مقاومتر هستند. عفونتهای بیوفیلمی میلیونها نفر را تحت تأثیر قرار داده و موجب مرگ و میر در سراسر جهان شده است. طبق گزارش مرکز کنترل و پیشگیری از بیماریها (CDC)، حدود 65٪ از بیماریهای عفونی مزمن توسط بیوفیلمهای میکروبی ایجاد میشوند. با وجود دانش زیادی در مورد پاتوژنز میکروبی و کاربردهای درمانی مدرن، بروز و مرگومیر ناشی از عفونتهای میکروبی همچنان بالا است. افزایش سریع مقاومت دارویی در باکتریهای پاتوژن نیز نگرانی جدی است. ماندگاری پاتوژنها در بیوفیلمها موجب عفونتهای مزمن و غیرقابل درمانی مانند عفونتهای دستگاه تنفسی فوقانی، فیبروز کیستیک ناشی از سودوموناس آئروژینوزا، عفونتهای دستگاه ادراری، پریودنتیت، کاتترها و سایر عفونتهای مرتبط میشود. در بیماران با سیستم ایمنی ضعیف، شروع عفونت توسط پاتوژنهای فرصتطلب که توانایی تشکیل بیوفیلم را دارند، میتواند به علائم شدید منجر شود و در بسیاری از موارد، منجر به مرگ گردد.
پیشبینی میشود که روشهای مبتنی بر نانوذرات برای کنترل و درمان بیوفیلمهای پاتوژن در دستگاهها و ایمپلنتهای پزشکی با استفاده از روش منحصر به فرد خود مفید باشند. به دلیل اندازه کوانتومی و سطح وسیع آنها، نانوذرات فلزی دارای جذب سطحی منحصر به فرد و فعالیت کاتالیزوری افزایش یافته هستند. نانوذرات مختلفی مانند Fe، Ni، Co، Mn و Zn به دلیل کاربردهای متعددشان از جمله در بیوایمینگ، آنتیاکسیدانها و علوم زیستی به عنوان آنتیمیکروبها شناخته شده و پذیرفته شدهاند. شواهد نوظهور نشان میدهند که نانوذرات میتوانند با خواص آنتیمیکروبی قوی خود به طور مؤثر چسبندگی میکروبی، تکثیر و تشکیل بیوفیلم را کاهش دهند. نانوذرات ZnO عمدتاً از طریق تولید ROS، که باعث آسیب اکسیداتیو و آزادسازی واسطههای التهابی میشود، سیتوتوکسیت را افزایش میدهند که در نهایت به مرگ سلول منتهی میشود. ZnO با تولید گونههای واکنشپذیر اکسیژن که باکتریها را میکشد، یکپارچگی غشای سلولی را مختل میکند. علاوه بر این، تولید هیدروژن پراکسید و Zn2+ نقش اساسی در فعالیت آنتیباکتریالی نانوذرات ایفا میکند. به همین منظور امین محسن زاده و همکاران مطالعهای با هدف بررسی اثر نانوذرات اکسید روی بر میزان بیان ژنهای بیوفیلم و مقاومت دارویی ایزولههای سودوموناس آئروژینوزا جداشده از نمونههای بالینی مراکز آموزشی و درمانی در تهران انجام دادند.
روش انتشار دیسک (کربی-بائر) برای شناسایی پروفایلهای مقاومت آنتیبیوتیکی در 50 ایزوله سودوموناس آئروژینوزا جداشده استفاده شد. علاوه بر این، حضور ژنهای pslA و bla-VIM با استفاده از واکنش زنجیرهای پلیمراز (PCR) تعیین شد. تشکیل بیوفیلم باکتری در 30 ایزوله که دارای ژن pslA بودند، با استفاده از روش میکروتیتر پلیت، کنگو رد آگار (CRA) و روش لولهای (TM) ارزیابی شد. نتایج نشان داد که 88% از ایزولههای مورد مطالعه در برابر مروپنم مقاوم بودند. رابطه نزدیکی بین توانایی تشکیل بیوفیلم توسط روش میکروتیتر پلیت که روش سنجش استاندارد تشکیل بیوفیلم میباشد و حضور ژن pslA وجود دارد. علاوه بر این، کاهش بیان ژن pslA در سویهی استاندارد ATCC27583 و ایزولههای بالینی که با ½ MIC نانوذرات اکسید روی + ½ MICمروپنم درمان شدند، نسبت به ایزولههایی که با ½ MIC مروپنم و ½ MIC نانوذرات اکسید روی به تنهایی درمان شدند، ثبت گردید.
نتایج این مطالعه که در مجلهی Cellular, Molecular and Biomedical Reports در سال 2024 به چاپ رسید نشان داد که 60% از ایزولهها حامل ژن pslA بودند و MIC نانوذرات اکسید روی در آنها بین 128 تا 1024 میکروگرم/میلیلیتر متغیر بود. با وجود تولید بیوفیلم قوی توسط ایزولههای حامل ژن pslA، درمان با ترکیب آنتیبیوتیک مروپنم + نانوذرات اکسید روی بهطور قابل توجهی میزان بیان ژن pslA و تشکیل بیوفیلم را کاهش داد. یافتههای این مطالعه تأکید بر فعالیت آنتیباکتریالی و ضدبیوفیلم تقویتشده ترکیب آنتیبیوتیک مروپنم + نانوذرات اکسید روی دارد و استراتژی امیدوارکنندهای برای مقابله با مقاومت نوظهور سودوموناس آئروژینوزا در برابر کارباپنمها ارائه میدهد.



ارسال نظر