آزادسازی مداوم هپارین از میکروذرات پلیلاکتیک اسید (PLLA) برای کاربردهای مهندسی بافت
هپارین یک داروی ضد انعقاد است که به طور معمول برای کنترل و محدود کردن لخته شدن خون (ترومبوز) استفاده میشود. این دارو به طور گستردهای برای کنترل التهاب، متاستاز غدد سرطانی و تحریک آنژیوژنز (تشکیل رگهای خونی جدید) کاربرد دارد. هپارین به عنوان یک داروی نسبتاً جدید در کاربردهای مهندسی بافت نیز به عنوان یک عامل مناسب برای تنظیم فعالیتهای بیولوژیکی مانند تمایز سلولهای بنیادی به کاردیومیوسیتها در نظر گرفته میشود.
هپارین در درمان طیف وسیعی از بیماریهای قلبی، از جمله حمله قلبی، جراحی بایپس قلبی و آنژیوپلاستی نیز تجویز میشود. برای جلوگیری از تکثیر سلولهای عضله صاف عروق که خطر بالقوهای برای بازگشت تنگی رگها بعد از آنژیوپلاستی است، نیاز به دوزهای بالای هپارین به مدت زمان طولانی وجود دارد. این امر ممکن است منجر به سمیت سیستمیک شود. بنابراین، سیستمهای مختلفی از جمله نوعی اسفنج هپارین بر اساس میکروذرات پلی (لاکتیک-کوالیک) اسید (PLGA) و نانوذرات حاوی هپارین برای آزادسازی آهسته و مداوم طراحی شده است. این میکروذرات حاوی هپارین در اسکافولدهای کلاژن، آلژینات و کیتوسان بارگذاری شدهاند تا کنترل بهتری بر آزادسازی هپارین فراهم کنند. تحقیقات دیگری نیز بر روی سیستمهای رهایش دارو در ماتریکس همزیست بر اساس بارگذاری هپارین در میکروذرات قابل تجزیه PLA در ماتریکس پلیمرهای آبدوست برای کنترل آزادسازی هپارین تا 25 روز انجام شده است. در سالهای اخیر، بارگذاری دارو در میکرو و نانوذرات پلیمر این امکان را فراهم کرده است که دارو به مدت طولانی و به طور مداوم تا 60 روز آزاد شود.
با وجود این مزایا، مکانیسم رسیدن هپارین به سایت هدف در عملکرد دارو نقش بسیار مهمی دارد. این مسئله به دلیل نیمهعمر کوتاه هپارین و فارماکوکینتیک پیچیده آن اهمیت دارد. تجویز دوزهای بالاتر هپارین برای اشباع سلولهای اندوتلیال ممکن است پاکسازی آنها را توسط جریان خون و کلیهها کندتر کند. با این حال، این امر میتواند منجر به عوارضی مانند هماتوم یا خونریزی در محل شود. از سوی دیگر، مقدار هپارین در پلاسما ممکن است با مقدار مجاز هپارین در بافت هدف متفاوت باشد. بنابراین حتی تجویز دوز مجاز هپارین نیز ممکن است به سمیت در سلولهای اندوتلیال منجر شود. این مسئله برای بیماران مبتلا به بیماریهای قلبی که در معرض حملات قلبی غیرمنتظره هستند، بسیار بحرانی است. انواع مختلفی از حاملها برای تحویل و آزادسازی مداوم هپارین به سایت هدف طراحی و معرفی شده است. بارگذاری هپارین داخل میکروذرات پلیمری میتواند آن را از محیط اطراف محافظت کرده، نرخ آزادسازی دارو را کنترل کرده، دوز مورد نیاز دارو را به بافت هدف تحویل دهد و اثرات درمانی آن را بهبود بخشد.
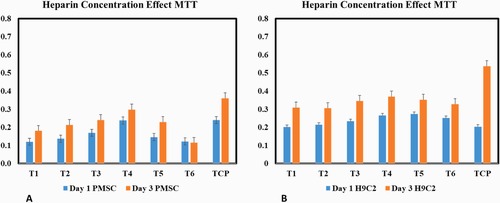
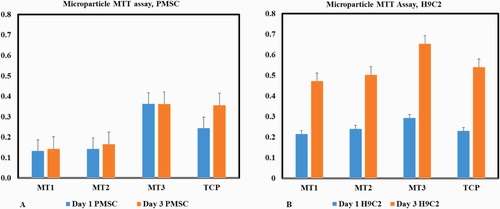
دوزهای پایین هپارین میتوانند به طور مثبت خواص بیولوژیکی سلولهای بنیادی مزانشیمی انسانی (hMSCs) را تحت تأثیر قرار داده و رشد سلولی این سلولها را افزایش دهند، در حالی که غلظتهای بالاتر دارو ممکن است منجر به افزایش اندازه سلولها شود. گزارش شده است که غلظتهای بالای هپارین باعث مرگ سلولی در سلولهای L929 میشود. پوششهای هپارینی در استنتها ممکن است از آسیب اکسیداتیو به سلولهای H9c2 و HUVEC در محیط بیولوژیکی مانند غشای دیالیز محافظت کند. هپارین همچنین بقاء سلولهای اندوتلیال رگ خونی انسانی (HUVEC) را در رگهای خونی مصنوعی با قطر کوچک تقویت میکند.
PLA یکی از بهترین پلیمرهای ایمن و تجزیهپذیر زیستی است که در بدن بدون نیاز به آنزیمها هیدرولیز و متابولیزه میشود. میکروذرات تجزیهپذیر مانند پلی لاکتیک اسید (PLA) با قطر کمتر از 250 میکرومتر توانایی نگهداری و حمل انواع مختلف داروها از جمله هپارین را در کاربردهای زیستپزشکی دارند. PLA پلیمر مناسبی برای تولید میکروسفرهای توخالی یا ذراتی با سوراخهای متعدد روی سطح با اندازه یکنواخت و کیفیت سطح خوب به عنوان حامل دارو است. هرچند این منافذ سطحی ممکن است مسیرهای بیشتری برای آزادسازی دارو فراهم کنند، اما میتوانند منجر به آزادسازی اولیه ناخواسته و سریع دارو در محیط بیولوژیکی شوند. با این حال، پوششهای پلیمری برای پوشاندن سوراخهای سطحی مانند پلیاتیلن گلیکول (PEG) میتوانند آزادسازی اولیه دارو را کاهش داده و کند کنند.
آزادسازی اولیه سریع از ذرات PLA هنوز هم یک مشکل چالشبرانگیز برای محققان است. راهکارهایی برای بهبود کارآیی انکپسولاسیون و آزادسازی کنترل شده داروهای بارگذاری شده در ذرات PLA وجود دارد، مانند درمان پلاسما، ترکیب پلیمر، پیوند عرضی حجمی و غیره. نرخ تخریب PLA در بدن با نفوذ آب بین زنجیرههای پلیمر شروع شده و پیوندهای استری شکسته میشود، بنابراین تخریب هم در سطح و هم در داخل پلیمر اتفاق میافتد.
به همین منظور مژده رجبی و همکاران مطالعهای با هدف آزادسازی مداوم هپارین از میکروذرات پلیلاکتیک اسید برای کاربردهای مهندسی بافت انجام دادند.
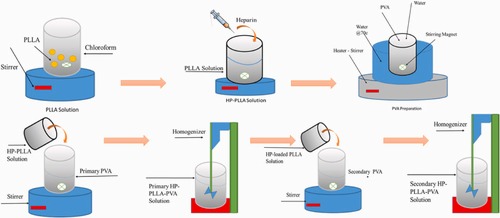
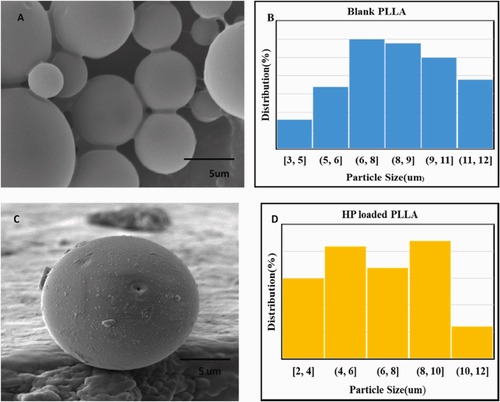
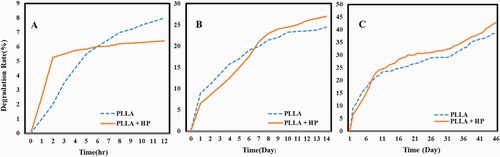
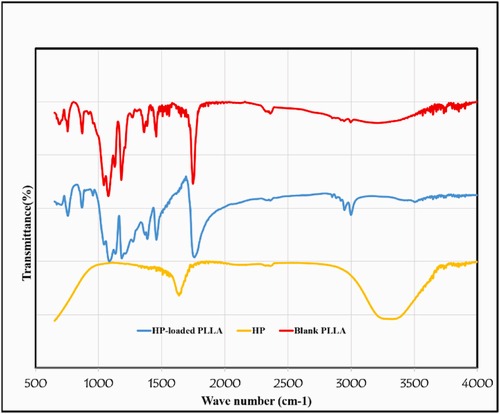
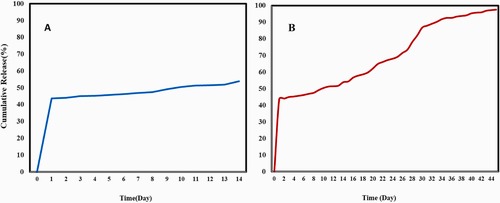
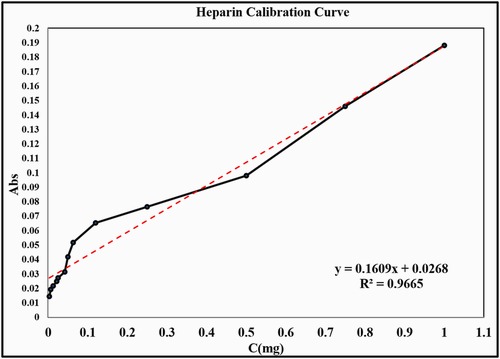
هپارین داخل میکروذرات پلی (L-اسید لاکتیک) با استفاده از روش امولسیون دوگانه انکپسوله شد، که از پلیوینیل الکل به عنوان پایدارکننده استفاده شد. کارایی انکپسولاسیون هپارین در میکروذرات 25.56٪ محاسبه شد. عملکرد طراحی با استفاده از طیفسنجی تبدیل مادون قرمز با بازتاب کل کاهشیافته، میکروسکوپ الکترونی روبشی و طیفسنجی پرتو ایکس پراکندگی انرژی ارزیابی شد. آزادسازی دارو و تخریب میکروذرات همراه با آزمایشهای بقاء سلولی انجام شد. نتایج این مطالعه که در مجله Polymer Testing در سال 2024 به چاپ رسید نشان داد که اندازه ذرات از 5 تا 10 میکرومتر متغیر بود و شواهد نشان داد که هپارین باعث تشکیل ذرات کوچکتر میشود. سیستم، یک الگوی آزادسازی مداوم دارو را در طول شش هفته با نرخ آزادسازی 54٪ در هفته دوم و 97.65٪ در هفته ششم نشان داد. تخریب میکروذرات بارگذاریشده با هپارین در هفته ششم به کمتر از 50٪ رسید و بارگذاری هپارین تأثیر قابل توجهی بر رفتار تخریب میکروذرات PLLA در PBS نداشت. علاوه بر این، غلظتهای هپارین بین 200 تا 400 میکروگرم/میلیلیتر بقاء سلولهای بنیادی مزانشیمی مشتق از جفت و H9c2 را افزایش داد. این یافتهها نشان میدهد که سیستم طراحیشده میتواند به عنوان یک راهکار مؤثر برای تحویل پایدار هپارین در طیف وسیعی از کاربردهای بیولوژیکی، به ویژه در مهندسی بافت قلب، مورد استفاده قرار گیرد.





ارسال نظر